Karbon er en utrolig viktig byggestein for alt levende. Molekyler som inneholder karbon er vanligvis betegnet som organiskeforbindelser, og er utrolig viktig for alt som lever (og ikke lever; fordi karbon finnes i både organiske og ikke organiske fornindelser).
Kjemien er delt inn i to grupper: Organisk kjemi, og uorganisk kjemi. Kort sagt: organisk kjemi dreier seg om karbonforbindelser, mens uorganisk om alt det andre.
Karbonatomet er meget spesielt. Grunnen til dette skylder de fire elektronene som befinner seg på dens ytterste skall. Karbonen har dermed fire mulige steder å binde seg med andre atomer, og skape mange ulike strukturer – som også kalles karbonskjellett.
Disse karbonatomene holdes sammen i en karbonforbindelse ved noe som kalles “elektronparbinding”.
En elektronparbinding er når to (karbon)atomer deler elektroner eller elektronpar. Det er tre forskjellige typer elektronparbindinger: enkeltbinding, dobbeltbinding, og trippelbinding.
Nå som vi vet dette kan vi gå over på hydrokarboner.
En hydrokarbon er et molekyl som består av hydrogen og karbonatomer.For å sette navn på hydrokarbonene har man et eget system. Man kan sette navn på et hydrokarbon ved å se på strukturformelen; som er noe som viser oss hvilke atomer er bundet sammen i en spesifik molekyl, og også viser oss om det er en enkelt, dobbelt, eller trippelbinding.

(En strukturformel ser ca. slik ut)
I dette eksempelet på navnsetting skal jeg bruke propan.
 (C3H8)
(C3H8)
For å sette navn på denne strukturformelen må jeg først og fremst telle antall karboner, og som vi kan se er det 3. Etter at man har funnet antall karboner kan man begynne med å i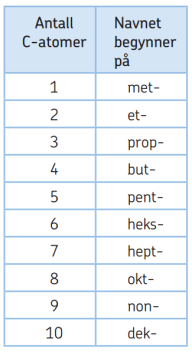 nsette forstavelsen utifra en slik tabell:
nsette forstavelsen utifra en slik tabell:
Da får vi forstavelsen “PROP”.
Deretter går vi over til den siste delen, som krever at vi ser på typen elektronparbinding strukturformelen har. Vi kan se at det er en enkeltbinding mellom alle atomene, så navnet vil ende på “-AN”. Dette er fordi enkeltbindinger slutter på -AN, dobbeltbindinger på -EN, og trippelbindinger på -YN.
Navnet på dette molekylet er da Propan.
Disse sluttstavelsene går inn på alkaner, alkener og alkyner.
En alkane er en mettet hydrokarbon.
Hydrogen atomet har bare plass til 1 elektron på dens ytterste skall, og kan derfor bare bindes med andre atomer ved en enkeltbinding. Karbonatomer har fire ledige plasser for elektroner å bindes på dens ytterste skall, og når alle disse plassene (som ikke er allerede opptatt/brukt av andre karbonatomer) er fylt med hydrogenatomer, kalles det en mettet hydrokarbon – eller en Alkane, og alltid ender på -an.
En Alkene er en umettet hydrokarbon. Dette er fordi – som jeg sa -et karbonatom har fire ledige plasser til å binde seg med andre atomer, men den kan faktisk bruke to eller flere av de plassene på en annen karbonatom; og kan derfor ha en dobbelt eller trippelbinding, i motsetning til enkeltbindinger, som jeg snakket om. 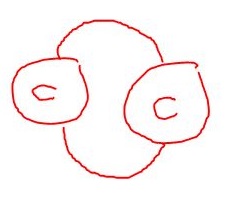
(En dobbeltbinding mellom to karbonatomer ser slik ut. )
Grunnen til at en alkene er umettet er fordi det ikke er like mye plass til hydrogenatomer i molekylet som det var i en enkeltbinding (alkane).
Siden Alkener er hydrokarboner med en eller flere dobbeltbindinger, slutter dens kjemiske navn på -en.
En Alkyne er veldig likt en Alkane, bare at den har en trippelbinding istedenfor en dobbeltbinding. Akynenes kjemiske navn ender på -yn.
